En este artículo le proporcionaremos un estudio detallado sobre la estructura del átomo y sus partículas subatómicas, incluidos los electrones, protones y neutrones. Además, les contaremos su historia y ahondaremos en todos aquellos individuos que participaron de su origen a lo largo del tiempo.
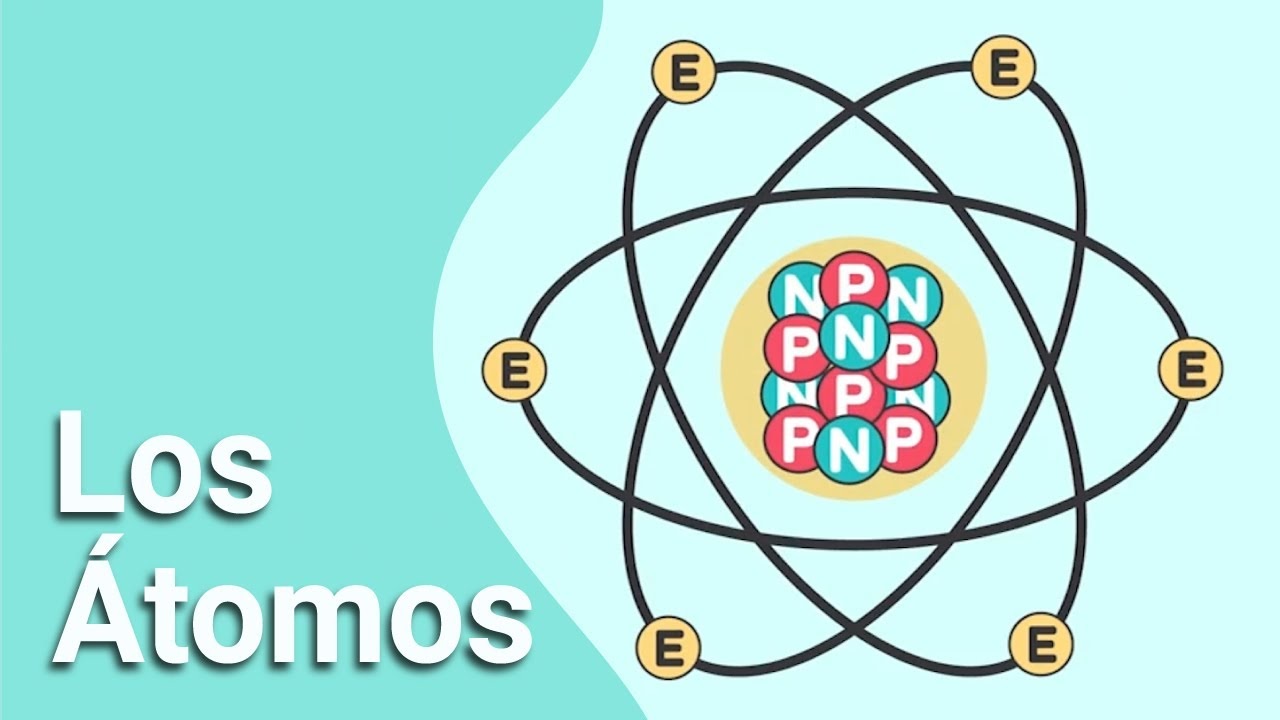
¿Qué son los átomos?
Los átomos son las partículas diminutas de un elemento que son responsables de las reacciones químicas. En la tabla periódica moderna, todos los átomos conocidos se agrupan en diferentes grupos y períodos. Entre ellos, algunos son estables y pueden existir de forma independiente, mientras que algunos de ellos son inestables debido al número de partículas subatómicas.
Hemos estudiado que los átomos están formados por tres partículas subatómicas que son electrones, protones y neutrones. Su estabilidad depende del número de estas partículas subatómicas. Por lo tanto, para lograr la estabilidad comparten sus electrones de valencia con los átomos de otros elementos. Los átomos intentan obtener estados de octeto compartiendo sus electrones y reuniendo ocho electrones de valencia en su capa más externa.
- Los átomos son las diminutas partículas de elementos que se involucran en una reacción química.
- El átomo fue descubierto por primera vez por John Dalton en 1808.
- Se supone que los átomos se crearon hace unos 13.700 millones de años.
Estructura del átomo y sus partes
Los átomos son la parte más pequeña de un elemento y, entre los siglos XVIII y XIX, el estudio de los modelos atómicos se convirtió en un tema común. Muchos científicos propusieron sus teorías sobre la estructura de los átomos basándose en sus estudios. Estas teorías se publicaron para profundizar en la estructura de los átomos, su constituyente. Las teorías más apreciadas sobre el modelo atómico fueron propuestas por:

- Juan Dalton
- JJ Thomson
- Niels Bohr
- Ernest Rutherford.
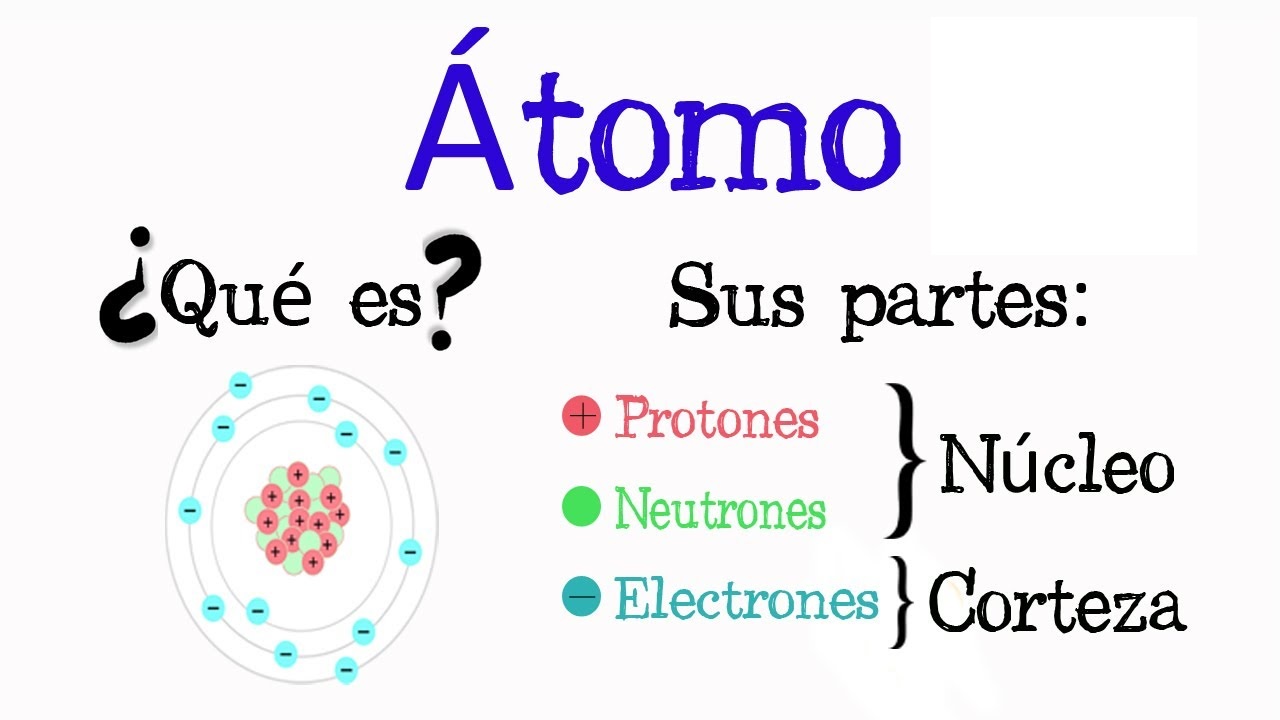
Un átomo consta de dos partes: un núcleo que se encuentra en el centro y transporta protones (partículas cargadas positivamente) y neutrones (partículas cargadas negativamente) y la otra parte es la capa externa que transporta electrones (partículas cargadas negativamente). Los electrones presentes en las capas exteriores giran continuamente alrededor del núcleo en un movimiento en espiral.
Estudiemos estas partículas subatómicas en detalle.
Protones (+)
Los protones son las partículas cargadas positivamente que están presentes en el núcleo de un átomo. En el año 1886 Goldstein descubrió que la relación de carga y masa de estas partículas cargadas positivamente depende de la naturaleza del gas. Esto concluye que la relación carga/masa (e/m) es diferente para diferentes gases.
Propiedades de los protones:
- Carga del protón: El protón tiene carga positiva. La carga de a es igual al número de cargas en un electrón (carga negativa). Carga en un protón = +1.602 × 10-19 Culombios
- Masa del protón: La masa de un protón se considera igual a la de un átomo de hidrógeno. Como un átomo de hidrógeno consta de un electrón y un protón en el que la masa de un electrón es despreciable, se puede decir que la masa de un protón es igual a la de un átomo de hidrógeno. Masa de un protón = 1.676 × 10 -27 Kg
Electrones (-)
Los electrones son partículas cargadas negativamente que están presentes en las capas externas de un átomo. En el año 1897, J.J Thomson descubrió los electrones con su experimento de tubos de rayos catódicos. La carga de un electrón es igual y opuesta a la de un protón en poder del átomo. Ambas cargas se neutralizan entre sí y, por lo tanto, los átomos son de naturaleza neutra.

Propiedades de los electrones:
- Carga del electrón: Un electrón es una partícula cargada negativamente. Carga en un electrón= -1.602 × 10-19 Culombios
- Masa del electrón: La masa de un electrón es diminuta en un átomo. Su masa es 1/1837 de un protón. Masa de un protón = 9,1093 × 10 -31 Kg
Neutrones (n)
Los neutrones son partículas subatómicas de naturaleza neutra, lo cual quiere decir que no llevan ninguna carga. Los neutrones son el componente principal del núcleo y se encuentran junto con los protones. La masa de un neutrón tiene una magnitud ligeramente superior a la de un protón. Los protones y neutrones presentes en el núcleo son los responsables de las propiedades químicas de un átomo. El concepto de neutrón fue propuesto por Ernest Rutherford en 1920 y fue descubierto por el físico británico James Chadwick en 1932.
Propiedades de los neutrones:
- Carga en un neutrón: Como los neutrones son partículas subatómicas con carga neutra, la carga que llevan es 0. Carga en un neutrón = 0
- Masa de un neutrón: La masa de un neutrón se puede calcular restando la masa del protón de la masa del núcleo de deuterio. La masa de un neutrón es 1,008 unidades de masa atómica (uma). Masa de un neutrón= 1.676 × 10-27 Kg
Aunque es una partícula subatómica neutra, se ve afectada por la presencia del campo magnético. Por lo que su momento magnético no es igual a cero. Los neutrones no se ven afectados por los campos eléctricos por ser una carga neutra.
Propiedades y comportamiento de los átomos
Número atómico
El número atómico te dice cuántos protones tiene un átomo. Por ejemplo, cada átomo de hidrógeno tiene el número atómico 1 porque solo tiene 1 protón. Los elementos que tienen números atómicos de hasta 92 se pueden encontrar en la naturaleza; los de más de 92 son creados por científicos en un laboratorio. El número atómico nos dice dónde podemos encontrar un elemento en la tabla periódica.
Masa atomica
La masa atómica es el número de protones y neutrones en un átomo. Aunque todos los átomos de un mismo elemento tienen el mismo número de protones, a veces tienen más neutrones (tales átomos se llaman isótopos). Por ejemplo, el hidrógeno tiene tres isótopos. La mayor parte del tiempo, un átomo de hidrógeno tiene un protón y un neutrón. A veces puedes encontrar isótopos de hidrógeno que tienen dos o tres neutrones, pero también tienen un solo protón.
En la mayoría de los elementos más ligeros, el núcleo de cada átomo tiene el mismo número de protones y neutrones. pero los elementos más pesados tienen más neutrones que protones. El uranio, por ejemplo, tiene 92 protones y 146 neutrones (su masa atómica es 238). La masa atómica nunca es un número entero, porque los científicos no solo suman protones y neutrones (utilizan una fórmula super complicada).
Carga eléctrica
Normalmente un átomo es eléctricamente neutro, pero puede ganar o perder electrones cuando choca con otros átomos. Los átomos que ganan o pierden electrones se llaman iones (tienen carga eléctrica). Los átomos que pierden electrones se convierten en iones positivos; Los átomos que ganan electrones se convierten en iones negativos.
Radioactividad
En algunos átomos el núcleo puede cambiar naturalmente. Tal átomo es radiactivo y, cuando cambia, produce rayos. En la naturaleza, hay algunos elementos que son radiactivos, como el uranio o el radio. En los laboratorios, los científicos pueden producir radiactividad bombardeando átomos con partículas más pequeñas.
Historia del átomo y sus orígenes
Toda la materia está formada por átomos. Esto es algo que ahora damos por sentado, y una de las cosas que aprendes al comienzo de las clases de química de la escuela secundaria o preparatoria. A pesar de esto, nuestras ideas sobre lo que es un átomo son sorprendentemente recientes: hace apenas cien años, los científicos aún debatían cómo era exactamente un átomo.

Aunque generalmente hablamos del siglo XIX, la idea de los átomos existía mucho antes. De hecho, tenemos que remontarnos hasta la Antigua Grecia para encontrar su génesis. La palabra «átomo» en realidad proviene del griego antiguo y se traduce aproximadamente como «indivisible». La teoría de la antigua Grecia se ha acreditado a varios eruditos diferentes, pero se atribuye con mayor frecuencia a Demócrito (460-370 a. C.) y su mentor Leucipo. Aunque sus ideas sobre los átomos eran rudimentarias en comparación con nuestros conceptos actuales, esbozaron la idea de que todo está hecho de átomos, esferas invisibles e indivisibles de materia de tipo y número infinitos.
Estos eruditos imaginaron que los átomos variaban en forma según el tipo. Imaginaron que los átomos de hierro tenían ganchos que los unían, lo que explicaba por qué el hierro era sólido a temperatura ambiente. Los átomos de agua eran suaves y resbaladizos, lo que explica por qué el agua era un líquido a temperatura ambiente y se podía verter. Aunque ahora sabemos que este no es el caso, sus ideas sentaron las bases para futuros modelos atómicos.
Sin embargo, fue una larga espera antes de que se construyeran estos cimientos. No fue hasta 1803 que el químico inglés John Dalton comenzó a desarrollar una definición más científica del átomo. Se basó en las ideas de los antiguos griegos al describir los átomos como esferas pequeñas y duras que son indivisibles y que los átomos de un elemento dado son idénticos entre sí. El último punto es uno que sigue siendo válido, con la notable excepción de los isótopos de diferentes elementos, que difieren en su número de neutrones. Sin embargo, dado que el neutrón no se descubriría hasta 1932, probablemente podamos perdonar a Dalton este descuido. También ideó teorías sobre cómo los átomos se combinan para formar compuestos, y también ideó el primer conjunto de símbolos químicos para los elementos conocidos.
El bosquejo de la teoría atómica de Dalton fue un comienzo, pero todavía no nos dijo mucho sobre la naturaleza de los átomos mismos. Lo que siguió fue otra pausa más breve en la que nuestro conocimiento de los átomos no progresó demasiado. Hubo algunos intentos de definir cómo se verían los átomos, como la sugerencia de Lord Kelvin de que podrían tener una estructura similar a un vórtice, pero no fue hasta poco después del comienzo del siglo XX que el progreso en la aclaración de la estructura atómica realmente comenzó.

El primer avance se produjo a fines del siglo XIX, cuando el físico inglés Joseph John (JJ) Thomson descubrió que el átomo no era tan indivisible como se afirmaba anteriormente. Realizó experimentos con rayos catódicos producidos en un tubo de descarga y descubrió que los rayos eran atraídos por placas de metal cargadas positivamente pero repelidos por las cargadas negativamente. De esto dedujo que los rayos deben tener carga negativa.
Al medir la carga de las partículas en los rayos, pudo deducir que eran dos mil veces más livianas que el hidrógeno, y al cambiar el metal del que estaba hecho el cátodo, pudo decir que estas partículas estaban presentes en muchos tipos de átomos. Había descubierto el electrón (aunque se refirió a él como un «corpúsculo») y demostró que los átomos no eran indivisibles, sino que tenían partes constituyentes más pequeñas. Este descubrimiento le valdría un Premio Nobel en 1906.
En 1904, presentó su modelo del átomo basado en sus hallazgos. Apodado «El modelo del pudín de ciruelas» (aunque no por el propio Thomson), contemplaba el átomo como una esfera de carga positiva, con electrones esparcidos por todas partes como ciruelas en un pudín. Los científicos habían comenzado a escudriñar las entrañas del átomo, pero el modelo de Thomson no duraría mucho tiempo, y fue uno de sus alumnos quien proporcionó la evidencia para enviarlo a la historia.
Ernest Rutherford fue un físico de Nueva Zelanda que estudió en la Universidad de Cambridge con Thomson. Fue su trabajo posterior en la Universidad de Manchester el que proporcionaría más información sobre el interior de un átomo. Este trabajo se produjo después de que ya había recibido un Premio Nobel en 1908 por sus investigaciones sobre la química de las sustancias radiactivas.
Rutherford ideó un experimento para sondear la estructura atómica que consistía en disparar partículas alfa cargadas positivamente a una fina lámina de oro. Las partículas alfa eran tan pequeñas que podían atravesar la lámina de oro y, según el modelo de Thomson, que mostraba la carga positiva difundida por todo el átomo, deberían hacerlo con poca o ninguna desviación. Al realizar este experimento, esperaba poder confirmar el modelo de Thomson, pero terminó haciendo exactamente lo contrario.
Durante el experimento, la mayoría de las partículas alfa atravesaron la lámina con poca o ninguna desviación. Sin embargo, un número muy pequeño de partículas se desvió de sus trayectorias originales en ángulos muy grandes. Esto fue completamente inesperado; como observó el propio Rutherford: «Fue casi tan increíble como si dispararas un proyectil de 15 pulgadas a un trozo de papel de seda y volviera y te golpeara». La única explicación posible era que la carga positiva no estaba repartida por todo el átomo, sino concentrada en un centro pequeño y denso: el núcleo. La mayor parte del resto del átomo era simplemente espacio vacío.
El descubrimiento del núcleo por parte de Rutherford significó que el modelo atómico necesitaba un replanteamiento. Propuso un modelo en el que los electrones orbitan alrededor del núcleo cargado positivamente. Si bien esto fue una mejora en el modelo de Thomson, no explicaba qué mantenía a los electrones en órbita en lugar de simplemente girar en espiral hacia el núcleo.
Niels Bohr fue un físico danés que se dedicó a intentar resolver los problemas con el modelo de Rutherford. Se dio cuenta de que la física clásica no podía explicar adecuadamente lo que estaba pasando a nivel atómico; en cambio, invocó la teoría cuántica para tratar de explicar la disposición de los electrones. Su modelo postulaba la existencia de niveles de energía o capas de electrones. Los electrones solo se pueden encontrar en estos niveles de energía específicos; en otras palabras, su energía estaba cuantificada y no podía tomar cualquier valor. Los electrones podían moverse entre estos niveles de energía (a los que Bohr se refiere como «estados estacionarios»), pero tenían que hacerlo absorbiendo o emitiendo energía.
La sugerencia de Bohr de niveles de energía estables abordó el problema de los electrones en espiral hacia el núcleo hasta cierto punto, pero no del todo. Las razones exactas son un poco más complejas de lo que vamos a discutir aquí, porque nos estamos adentrando en el complejo mundo de la mecánica cuántica; y como dijo el mismo Bohr, «Si la mecánica cuántica no te ha impactado profundamente, es que aún no la has entendido». En otras palabras, se pone un poco raro.

El modelo de Bohr no resolvió todos los problemas del modelo atómico. Funcionó bien para los átomos de hidrógeno, pero no pudo explicar las observaciones de elementos más pesados. También viola el Principio de Incertidumbre de Heisenberg, una de las piedras angulares de la mecánica cuántica, que establece que no podemos saber tanto la posición exacta como el momento de un electrón. Aún así, este principio no se postuló hasta varios años después de que Bohr propusiera su modelo. A pesar de todo esto, el de Bohr probablemente sigue siendo el modelo de átomo con el que está más familiarizado, ya que a menudo es el que se presentó por primera vez durante los cursos de química de la escuela secundaria. Todavía tiene sus usos también; es bastante útil para explicar los enlaces químicos y la reactividad de algunos grupos de elementos a un nivel simple.
En cualquier caso, el modelo todavía necesitaba refinarse. En este punto, muchos científicos estaban investigando y tratando de desarrollar el modelo cuántico del átomo. El principal de ellos fue el físico austriaco Erwin Schrödinger, de quien probablemente hayas oído hablar antes. En 1926, Schrödinger propuso que, en lugar de que los electrones se muevan en órbitas o capas fijas, los electrones se comporten como ondas.
En 1932, el físico inglés James Chadwick (alumno de Ernest Rutherford) descubrió la existencia del neutrón, completando nuestra imagen de las partículas subatómicas que forman un átomo. La historia tampoco termina ahí; Desde entonces, los físicos han descubierto que los protones y neutrones que forman el núcleo son divisibles en partículas llamadas quarks. En cualquier caso, el átomo nos da un gran ejemplo de cómo los modelos científicos pueden cambiar con el tiempo y muestra cómo la nueva evidencia puede conducir a nuevos modelos.